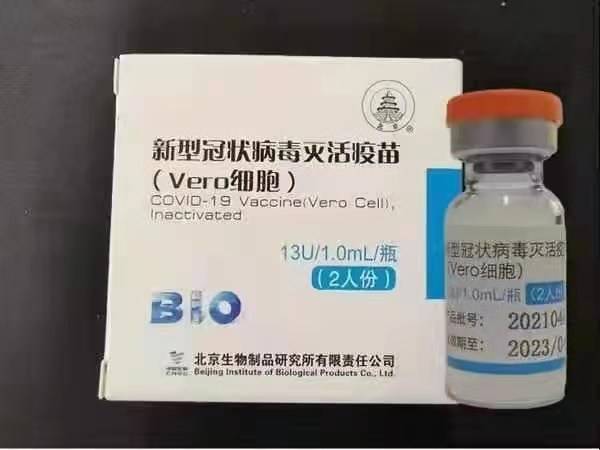
Sinopharm (Beijing): BBIBP-CorV
TAHAP 1
1 Percobaan
ChiCTR2000032459
Cina
TAHAP 2
2 Percobaan
NCT04962906
Argentina
ChiCTR2000032459
Cina
TAHAP 3
6 Percobaan
NCT04984408
ChiCTR2000034780
Uni Emirat Arab
NCT04612972
Peru
NCT04510207
Bahrain, Mesir, Yordania, Uni Emirat Arab
NCT04560881, BIBP2020003AR
Argentina
NCT04917523
Uni Emirat Arab
Persetujuan
Daftar Penggunaan Darurat WHO 59 Negara
Angola、Argentina、Bahrain、Bangladesh、Belarus、Belize、Bolivia (Plurinational State of)、Brazil、Brunei Darussalam、Cambodia、Cameroon、Chad、China、Comoros、Mesir、Equatorial Guinea、Gabon、Gambia、Georgia、Guyana、Hongariandonesia Iran (Republik Islam)、Irak、Yordania、KyrgyzstanRepublik Demokratik Rakyat Laos
Lebanon、MalaysiaMaladewa、Mauritania、auritius、Mongolia、Montenegro、Maroko、Mozambik、Namibia、Nepal、Niger、Makedonia Utara、Pakistan、Paraguay、Peru、Filipina、Republik Kongo、enegal、Serbia、Seychelles、Sierra Leone、Solomon Kepulauan、Somalia、Sri LankaThailandTrinidad dan Tobago、Tunisia、Uni Emirat Arab、Venezuela (Republik Bolivia)、Vietnam、Zimbabwe
Sinopharm BBIBP-CorV COVID-19 adalah vaksin tidak aktif yang terbuat dari partikel virus yang ditumbuhkan dengan kultur yang tidak memiliki kemampuan patogen. Kandidat vaksin ini dikembangkan oleh Sinopharm Holdings dan Institut Produk Biologi Beijing.
Vaksin Sinopharm BBIBP-CorV bekerja dengan memungkinkan sistem kekebalan tubuh memproduksi antibodi terhadap virus corona beta SARS-CoV-2. Vaksin virus yang tidak aktif telah digunakan selama beberapa dekade, seperti vaksin rabies dan vaksin hepatitis A. Perkembangan teknologi ini telah berhasil diterapkan pada banyak vaksin terkenal, seperti vaksin rabies.
Strain SARS-CoV-2 Sinopharm (strain WIV04 dan nomor perpustakaan MN996528) diisolasi dari seorang pasien di Rumah Sakit Jinyintan di Wuhan, China. Virus diperbanyak dalam biakan dalam garis sel Vero yang kompeten, dan supernatan sel yang terinfeksi diinaktivasi dengan -propiolakton (1:4000 vol/vol, 2 hingga 8°C) selama 48 jam. Setelah klarifikasi puing-puing sel dan ultrafiltrasi, inaktivasi -propiolakton kedua dilakukan di bawah kondisi yang sama dengan inaktivasi pertama. Menurut WHO, vaksin tersebut diadsorpsi ke 0,5 mg tawas dan dimasukkan ke dalam jarum suntik yang sudah diisi sebelumnya dalam 0,5 mL saline buffer fosfat steril tanpa bahan pengawet.
Pada 31 Desember 2020, Administrasi Obat Negara mengumumkan persetujuan vaksin eksperimental yang dikembangkan oleh Sinopharm.
Pada 7 Mei 2021, Organisasi Kesehatan Dunia mengumumkan persetujuan vaksin. Daftar penggunaan darurat WHO memungkinkan negara-negara untuk mempercepat persetujuan peraturan mereka sendiri untuk mengimpor dan mengelola vaksin COVID-19. Kelompok Ahli Penasihat WHO tentang Strategi Imunisasi juga telah menyelesaikan tinjauannya terhadap vaksin. Berdasarkan semua bukti yang ada, WHO merekomendasikan dua dosis vaksin, dengan interval tiga hingga empat minggu, untuk orang dewasa berusia 18 tahun ke atas. Kemanjuran vaksin terhadap penyakit simtomatik dan rawat inap diperkirakan 79% untuk semua kelompok umur digabungkan.
American Medical Association menerbitkan "Uji Coba Klinis Acak: Efek dari 2 Vaksin SARS-CoV-2 yang Tidak Aktif pada Infeksi COVID-19 Bergejala pada Orang Dewasa" pada 26 Mei 2021, menyimpulkan bahwa "dalam analisis sementara yang telah ditentukan sebelumnya dari uji klinis acak, dewasa Kedua vaksin SARS-CoV-2 yang tidak aktif yang diberikan dalam analisis sementara yang ditentukan sebelumnya dari uji klinis acak ini secara signifikan mengurangi risiko gejala COVID-19, dan efek samping yang serius jarang terjadi." Dalam uji coba acak fase 3 ini pada orang dewasa, kemanjuran 2 vaksin virus utuh yang tidak aktif pada kasus COVID-19 yang bergejala adalah masing-masing 72,8% dan 78,1%. 2 vaksin memiliki efek samping serius yang jarang terjadi dengan frekuensi yang sama dengan kelompok kontrol yang hanya memiliki tawas, dan sebagian besar tidak terkait dengan vaksinasi. Analisis eksplorasi menemukan bahwa 2 vaksin menginduksi antibodi penetralisir terukur, mirip dengan hasil uji coba fase 1/2.
Kelompok Kerja WHO SAGE menerbitkan ulasan vaksin COVID-19 Sinopharm/BBIBP pada 10 Mei 2021. Vaksin COVID-19 GAVI menggabungkan monitor botol vaksin yang memberi tahu petugas kesehatan apakah vaksin telah disimpan dengan benar dan belum terpapar terlalu panas. Akibatnya, kerusakan, GAVI melaporkan pada 14 Mei 2021. Label pintar yang diproduksi oleh Zebra Technologies dan dibuat oleh Temptime Corporation, terdiri dari lingkaran dengan kotak berwarna lebih terang di tengahnya, terbuat dari bahan kimia tidak berwarna yang mengembangkan warna secara permanen seiring waktu . Ini menjadi lebih gelap untuk memberikan indikasi visual dari paparan panas kumulatif. Setelah botol terkena panas di luar jangkauan penyimpanan optimalnya, kotak menjadi lebih gelap daripada lingkaran, yang menunjukkan bahwa vaksin tidak boleh lagi digunakan.
Obat Nasional BBIBP-CorV perpustakaan obat vaksin COVID-19 nomor registrasi: DB15807.